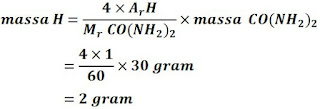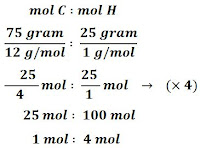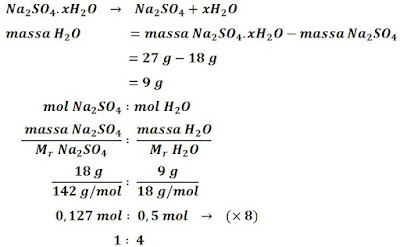Cara Menentukan Rumus Empiris dan Rumus Molekul pada Senyawa - Sesuai dengan judul diatas kali ini kita akan melanjutkan materi tentang Rumus Empiris dan Rumus Molekul. Ingat sebelumnya kita sudah membahas tentang Konsep Mol, bagi yang ingin membacanya bisa klik disini. Materi yang dibahas di kelas 10 SMA ini adalah sebagai konsep dasar yang nantinya akan selalu digunakan di materi selanjutnya.
 |
| Google Image - Cara Menentukan Rumus Empiris dan Rumus Molekul pada Senyawa |
Kadar Unsur dalam Senyawa
Senyawa yang ada di alam biasanya memiliki kadar unsurnya masing-masing. Kadar unsur dalam suatu senyawa biasanya dinyatakan dalam bentuk %. Rumus untuk mencari kadar unsur dalam suatu senyawa adalah sebagai berikut.
keterangan: AₐBₓ = rumus senyawa
A dan B = unsur
a dan b = angka indeks
Contoh 1.
Berapa kadar unsur C dan O dalam senyawa gas CO₂? (Ar C = 12, Ar O = 16)
Jawab
Mr CO₂ = Ar C + (2 × Ar O)
= 12 + (2 × 16)
= 12 + 32
= 44
Contoh 2.
Berapa massa hidrogen yang terkandung dalam 30 gram senyawa CO(NH₂)₂? (Ar C = 12, Ar O = 16, Ar N = 14, Ar H = 1)
Jawab
Mr CO(NH₂)₂ = Ar C + Ar O + (2 × Ar N) + (4 × Ar H)
= 12 + 16 + (2 × 14) + (4 × 1)
= 60
Rumus Empiris
Rumus empiris adalah perbandingan paling sederhana dari rumus kimia yang dimana atom-atomnya membentuk sebuah senyawa. Rumus Empiris (RE) merupakan rumus kimia yang memiliki perbandingan atom yang tidak dapat disederhanakan lagi.
Langkah-langkah untuk menentukan RE suatu senyawa:
- Menentukan perbandingan massa atom-atom penyusun senyawa, jika dalam bentuk persen maka harus di ubah menjadi pecahan.
- Mengubah perbandingan massa menjadi perbandingan mol, cara mencari nilai mol bisa klik disini.
- Perbandingan mol atom-atom ini merupakan RE senyawa.
Tentukan rumus empiris senyawa yang mengandung 75% atom karbon (C) dan 25% atom hidrogen (H)? (Ar C = 12, Ar H = 1)
Jawab
Misalkan 75% = 75 gram, 25% = 25 gram, maka total 100% = 100 gram.Jadi, rumus empiris dari senyawa diatas adalah CH₄.
Rumus Molekul
Rumus molekul adalah rumus kimia yang menunjukkan jumlah atom yang bergabung membentuk sebuah senyawa atau bisa dikatakan rumus molekul merupakan lambang dari senyawa. Rumus Molekul (RM) merupakan rumus kimia yang memiliki perbandingan atom yang dapat disederhanakan menjadi rumus empiris atau kompleks dari rumus empiris.
Langkah-langkah untuk menentukan RE suatu senyawa:
- Menentukan RE senyawa.
- Mencari massa molekul relatif senyawa (Mr).
- Mencari nilai n dari persamaan → (RE)n = Mr
- Mengalikan nilai n kedalam RE sehingga di peroleh RM (RM = n×(RE))
Contoh 4.
Tentukan rumus molekul dari enyawa hidrokarbon (Mr = 56) mengandung 24 g unsur karbon dan 4 g unsur hidrogen. (Ar C = 12, Ar H = 1)
Jawab
Rumus empiris senyawa tersebut adalah CH₂.
(RE)n = Mr
(Ar C + (2 × Ar H))n = 56
(12 + 2)n = 56
14n = 56
n = 4
RM = n×(RE)
= 4×(CH₂)
= C₄H₈
Jadi, rumus molekul senyawa tersebut adalah C₄H₈.
Senyawa Hidrat
Senyawa hidrat adalah jenis molekul padatan berbentuk kristal yang di dalamnya terkandung air (H₂O), misalnya senyawa CuSO₄.5H₂O, ini berarti tiap-tiap molekul tembaga(II)sulfat (CuSO₄) mengikat 5 molekul H₂O. Senyawa yang dalam rumusnya mangandung air kristal disebut senyawa hidrat, sedangkan yang tidak mengandung air kristal disebut senyawa anhidrat. Secara matematis rumus senyawa hidrat dapat dituliskan sebagai berikut.
Cara untuk menentukan jumlah molekul hidrat yang terikat dalam suatu senyawa adalah dengan memanaskan senyawa hidrat tersebut sampai senyawa hidrat berubah menjadi senyawa anhidrat. Kemudian, menghitung selisih massa senyawa sebelum dan sesudah sehingga didapatkan nilai perbandingan molnya.
Contoh 5.
Suatu garam natrium sulfat hidrat sebanyak 27 g dipanaskan menghasilkan 18 g natrium sulfat anhidrat. Berapakah jumlah molekul air yang ada pada garam natrium sulfat hidrat? Mr Na₂SO₄ = 142 g/mol dan Mr H₂O = 18 g/mol.
Jawab
Jumlah molekul air = 4
Jadi, rumus molekul garam natrium sulfat hidrat tersebut adalah Na₂SO₄.4H₂O.
Cara Menentukan Rumus Empiris dan Rumus Molekul pada Senyawa - Mungkin cukup dulu ya pembahasan singkat ini tentang Rumus Empiris dan Rumus Molekul. Semoga pembahasan singkat diatas dapat bermanfaat bagi teman setia Sains Seru. Jika ada yang mau ditanyakan bisa tinggalkan di kolom komentar dibawah ya. Untuk pembahasan Pereaksi Pembatas dapat ikuti terus update artikel disini ya. Terimakasih atas perhatiannya, See You.